2012年10 月21日,清华大学生命学院杨茂君研究组在Nature在线发表了题为《Structural insight into the type-II mitochondrial NADH dehydrogenases(线粒体II型NADH脱氢酶的结构与功能)》的科研论文,首次报道了二型NADH-泛醌氧化还原酶Ndi1的晶体结构,并 对其生理功能和工作机制进行了详细的研究。生命学院博士生冯越、李文斐、李坚为本文的共同第一作者,杨茂君博士为本文的通讯作者。
众所周知,位于线粒体内膜上的呼吸链是生物体最重要的能量来源。呼吸链,又称电子传递链,由复合物I-V组成,是将代谢过程中产生的电子从NADH或FADH2向 氧分子传递的系统,最终生成ATP为生物体提供能量。其中的复合物Ⅰ,又称NADH-泛醌氧化还原酶(NDH-1),是这些电子进入电子传递链最重要的入 口。在多种生物中,复合物Ⅰ可以被一类称为二型NADH氧化还原酶(NDH-2)的蛋白所取代,这类蛋白以FAD为辅基催化电子从NADH传递给泛醌 (UQ)。NDH-2在多种病原微生物中高度保守,如结核杆菌、疟原虫、刚地弓形虫等。由于在呼吸链中的重要地位,这类蛋白一直被认为是一个重要的药物靶 点。同时,很多人类疾病尤其是帕金森氏病等神经退行性疾病都与复合物Ⅰ的缺陷有关,而外源表达的Ndi1蛋白(酿酒酵母的一种NDH-2)可以在包括小鼠 在内的多种生物中取代缺陷的复合物I使机体恢复正常。此外该蛋白在果蝇中的表达可以大大延长果蝇的寿命。因此Ndi1也被认为是一个潜在的基因治疗靶点。
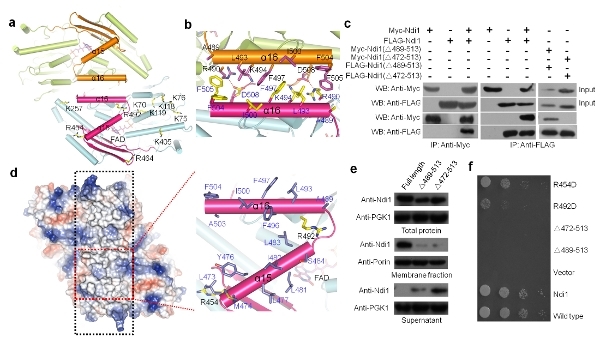
自1966年被首次发现以来,人们对NDH-2的生化特性和催化机制进行了大量的研究。但由于缺少这类蛋白的结构信息,现有的许多生化数据始终得不 到很好的解释,而且存在多处矛盾亟待解决。杨茂君研究组经过多年的不懈努力,成功解析了Ndi1这一重要蛋白质的高分辨率晶体结构及Ndi1与NADH、 UQ以及NADH-UQ三种底物复合物的晶体结构。有趣的是,在所有晶体结构中,Ndi1均以同源二聚体形式存在,这与先前认为其可能以单体形式发挥功能 的猜测不同。生物信息学和结构分析发现,Ndi1具有一个在NDH-2中高度保守的C端结构域(CTD),该结构域介导了Ndi1二聚体化,进而使其形成 一个广泛的疏水区域,这赋予了Ndi1附着在线粒体内膜上的特性。随后的生物化学和细胞生物学实验都证实了以上的观点。同时,三种Ndi1-底物复合物结 构的解析首次证明了在Ndi1中同时存在两个泛醌结合位点。结合电子顺磁共振实验的结果,作者最终提出了Ndi1催化电子从NADH传递给泛醌UQ的机制 (图)。这些研究结果不但很好的解释了当前许多看似相互矛盾的生化数据,而且为研究NDH-2介导电子传递的详细机制、针对NDH-2的药物设计以及更好 地将Ndi1应用于基因治疗提供了基础。在该研究中,杨茂君课题组主要通过大量的结构生物学研究提出了该家族蛋白的可能的工作机制,然后综合运用了生物信 息学、生物化学与分子生物学、细胞生物学、遗传学、以及物理学等多学科手段证明了这些发现,系统地研究了该家族最具代表性的蛋白Ndi1的各方面特性,全 方位地展示了该蛋白发挥其线粒体呼吸链电子传递入口这一重要生物学功能的机理,是迄今已报道的该蛋白家族的研究中最系统、最全面的一次研究。
该研究与生命学院王佳伟副教授、吴嘉炜教授和周兵教授,中国科学院植物研究所的曾庆银研究员以及中国科技大学的田长麟研 究员等研究组合作完成。上海同步辐射以及合肥强磁场科学中心分别为晶体数据收集和电子顺磁共振实验提供了及时有效的支持。该研究获得科技部重大研究计划、 国家自然科学基金委重点项目及清华-北大生命联合中心的支持。
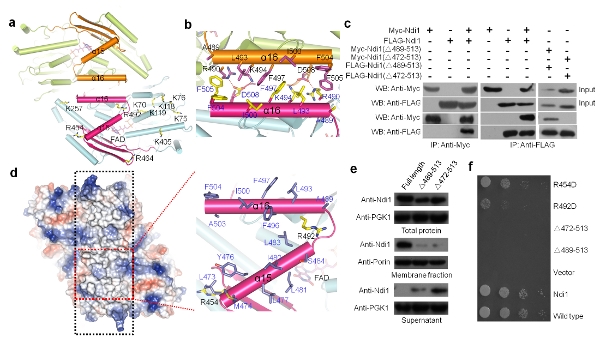
Ndi1蛋白质C端的功能
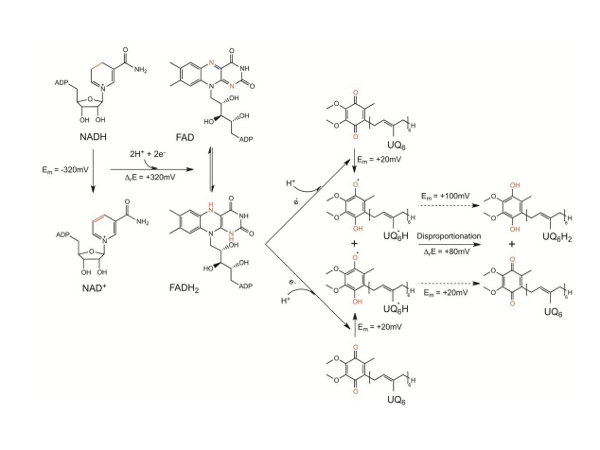
Ndi1蛋白中电子传递过程