2012年10月16日,清华大学生命学院杨茂君博士研究组在《美国科学院院刊》(《PNAS》)在线发表了名为《Structure and molecular mechanism of an anion-selective mechanosensitive channel of small conductance》的科研论文,首次报道了一种具有阴离子选择性的机械敏感性离子通道的晶体结构,对其功能特性和离子选择机制进行了研究。生命学院 博士生冯越等为本文的共同第一作者,杨茂君博士为本文的通讯作者。
当细胞和有机体受到环境中的机械力刺激时,机械力信号随即转化成生物信号,使细胞作出反应,这个过程称为机械传导,它被认为是最古老的感觉之一,是 从细菌到人类所有活的有机体共有的特征。在机械信号传导过程中,机械敏感性离子通道(Mechanosensitive channel,Msc)发挥了重要功能。这类通道广泛存在于所有原核和真核细胞中,是地球上最古老以及最广泛存在的生物膜上的孔洞。当细胞感受到机械刺 激时,这类离子通道可以打开,使溶液中的某些离子被动地顺着浓度梯度通过生物膜。在细菌等低等生物中,Msc作为细胞的应急开关,在环境渗透压突然变化的 时候调节细胞内外的渗透压平衡,使它们适应在一定范围内变化的渗透压环境。在哺乳动物中,机械敏感性通道参与多种重要的生命过程,如细胞体积和形状调控、 组织生长和形态发生、听觉和平衡感的产生、血压和体液平衡、多精授精的防止等等。Msc的功能失常与神经和肌肉的退化,动脉硬化,高血压,青光眼等疾病密 切相关。然而目前对于这类通道的研究主要集中于其门控机制,作为离子通道研究的另一重点——其离子选择机制却一直没有研究清楚。
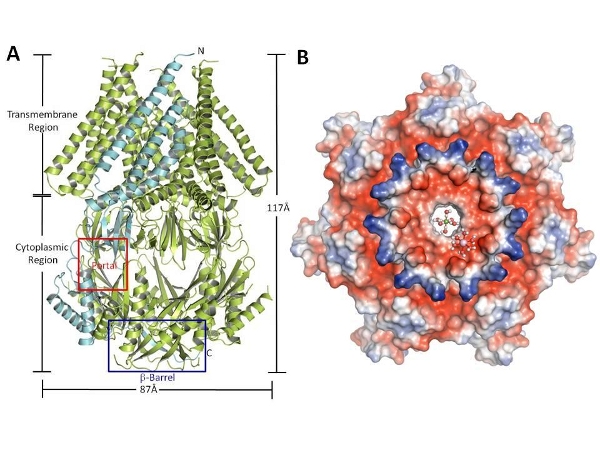
这类通道的离子选择性各不相同,而目前仅有的结构信息也只是针对无明显选择性的大肠杆菌的MscS。为了理解这类通道的离子选择机制,杨茂君研究组 克隆并检测了60多个物种的MscS的离子选择性,最终成功鉴定到了一个具有强阴离子选择性的通道蛋白。经过多年的不懈努力,该研究组解析了其晶体结构并 对其离子选择机制进行了研究。长久以来,基于对细菌MscS的研究,人们一直认为离子进入这类通道是通过位于其胞内区侧面的7个孔洞(图A)。然而,杨茂 君研究组通过对晶体结构的分析发现,相比7个孔洞而言,位于该通道胞内区底部的β桶结构域很可能是更主要的离子入口(图A)。令人惊奇的是,体内和体外的 电生理实验表明,将该通道和大肠杆菌MscS的β桶结构域互换之后,两个通道的离子选择性竟然也随之互换,这充分验证了他们之前的推测。通过进一步的突变 体实验,杨茂君研究组成功找到了该结构域介导离子选择性的关键氨基酸残基,进而提出了该通道的阴离子选择机制模型(图B)。
多年以来,离子通道的离子选择机制一直是生物学的研究热点。Roderick MacKinnon更是因为在钾离子通道结构和机制研究中的杰出贡献获得了2003年的诺贝尔化学奖。相比之下,阴离子通道的离子选择机制则一直存在争 议。杨茂君研究组在该工作中所取得的成果为理解阴离子如何被通道蛋白所选择这一基本问题提供了新的视点,同时也为研究这类最古老的通道蛋白提供了新的思 路。
这项研究与中科院上海药物研究所的李扬教授研究组合作完成。上海同步辐射为晶体数据收集提供了及时有效的支持。