2012年12月19日,清华大学生命科学学院施一公教授带领其研究组在《自然》杂志以研究长文(Research Article)的形式发表了题为《早老素家族天冬氨酸膜整合蛋白酶的结构》(Structure of a presenilin family intramembrane aspartate protease)的研究论文,首次报道了人的早老素蛋白(presenilin) 在古细菌Methanoculleus marisnigri JR1中同源蛋白PSH的晶体结构。
阿兹海默症(Alzheimer disease,AD),又称老年痴呆症,是一种致死性神经退行性疾病。该病多发于65岁以上的老人,然而也有少见的早发性阿兹海默症(Early-onset AD)病患会提早发病。随着人口的老龄化,AD的发病率逐年上升,在2006年,全世界约有两千六百万AD病患,到2050年时预估全球每85人就有一人罹患该病。阿兹海默症患者临床表现为逐渐严重的认知障碍, 对患者及家庭都会造成严重的影响。在发达国家中,阿兹海默症是社会中花费最高的疾病之一,而对于该病,现在仍没有较好的治疗方法。目前研究认为,阿兹海默 症是由于γ-secretase活性中心蛋白早老素(presenilin)发生突变,从而导致其对底物淀粉样前体蛋白(APP)的酶切位点发生改变,形 成更容易在大脑中沉积的β淀粉样蛋白(Aβ)导致的。因此, 对γ-secretase活性中心蛋白早老素的晶体学研究,能够帮助人们更清楚地了解阿兹海默症的发病机理,进而为治愈阿兹海默症提供理论依据。
施一公教授领导的研究组一直以来将γ-secretase及其同源蛋白的结构与功能作为主要研究方向。经过多年努力,他们今年获得了早老素在古细菌 中同源蛋白PSH的结构。PSH与人源早老素蛋白有着高达50%的序列相似性,进化上高度保守。PSH蛋白三维晶体结构呈现出全新的 “presenilin fold”折叠方式。该蛋白由9个跨膜螺旋组成,穿膜螺旋1-6形成N端结构域(NTD),7-9形成C端结构域(CTD);两个催化残基天冬氨酸 (D162和D220)分别位于穿膜螺旋6和7上,并且包埋在膜内。通过结构分析,并且结合之前相关的生化研究结果,研究组提出了底物以及水分子进入 PSH的通道模型。之后,研究组又基于序列的高度保守性,利用计算机同源建模,搭建了人源早老素蛋白的三维结构。根据该模型,进一步对引发阿兹海默症相关 早老素突变残基进行了生化研究。
这一研究是施一公教授继2006年和2007年在《自然-结构与分子生物学》(Nature Structural & Molecular Biology)和《科学》(Science)分别发表Rhomboid和Site-2 protease两个家族的膜整合蛋白酶的晶体结构之后,对最后一个家族,天冬氨酸膜整合蛋白酶的重要结构生物学研究成果,推近了人们对阿兹海默症致病机 理的认识和理解,也为之后基于晶体结构的药物设计和筛选打下了良好的基础。生命科学学院王佳伟博士参与合作,生命科学学院的博士研究生李晓淳和党尚宇为文 章的共同第一作者。
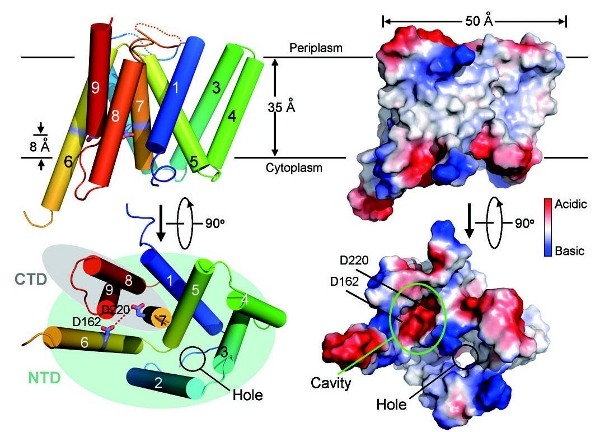
早老素同源蛋白PSH的晶体结构
