真核生物通过改变其表观基因组景观和转录程序来适应环境波动。核小体组蛋白携带重要的表观遗传信息并调控基因表达,然而与染色质结合的组蛋白交换的机制仍然不清楚。
2023年8月29日,清华大学生命科学院欧光朔实验室在《The EMBO Journal》发表了题为“Global histone H2B degradation regulates insulin/IGF signaling-mediated nutrient stress”的研究文章,报道了组蛋白H2B系统性降解调控胰岛素信号介导的营养应激。
欧光朔实验室意外地发现在饥饿期间线虫(Caenorhabditis elegans)中的组蛋白H2B会全面降解。欧光朔实验室通过遗传筛选识别出在饥饿动物中阻止H2B降解的泛素和与泛素相关酶的突变,确定赖氨酸31是染色质结合H2B泛素化和消除的关键残基。在饮食充足的动物中,当胰岛素/IGF信号减弱时,保留异常的核小体H2B增加了FOXO转录因子DAF-16与染色质的结合,生成有害于动物生存的非正常基因表达谱。这项工作还报道了泛素-蛋白酶体系统在人类细胞中调控染色体组蛋白的更新。在幼虫发育过程中,表皮细胞在与上皮细胞融合后也会进行H2B更新。这些结果提示组蛋白系统性降解可能是控制表观基因组动态变化的普遍机制。
论文的第一作者为清华大学博士后朱志文,现为苏州大学基础医学与生物科学学院分子酶学研究所特聘副教授,通讯作者是欧光朔教授。清华大学邓海腾、李寅青,北京生命科学研究所董梦秋,中国科学技术大学光寿红等教授实验室对本课题提供了帮助。本研究工作得到了清华-北大生命科学联合中心、生物结构前沿中心、清华大学-IDG/麦戈文脑科学研究院、基金委和科技部等相关机构的经费资助。
原文链接: https://doi.org/10.15252/embj.2022113328
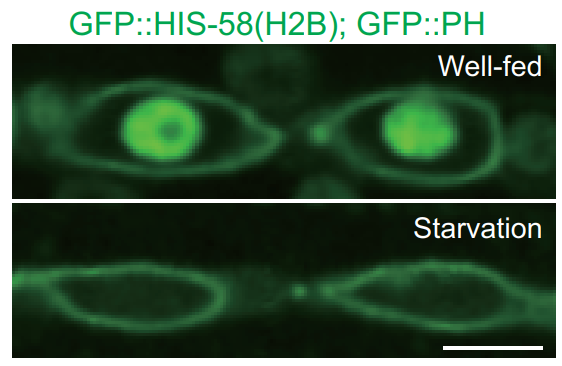
图:饥饿线虫组蛋白H2B会全面降解
